العدد الذري (Atomic Number) هو، ببساطة، عدد البروتونات الموجودة في نواة كل ذرة من ذرات عنصر معين. كما يُرمز للعدد الذري عالمياً بالرمز (Z).
هذا العدد هو بمثابة “بصمة الإصبع” أو “بطاقة الهوية” الفريدة لكل عنصر. إنه العامل الوحيد الذي يحدد هوية العنصر الكيميائي.
مثال بسيط:
- أي ذرة في الكون تحتوي على 6 بروتونات هي ذرة كربون.
- أي ذرة تحتوي على 8 بروتونات هي ذرة أكسجين.
- أي ذرة تحتوي على 1 بروتون فقط هي ذرة هيدروجين.
إذا تغير عدد البروتونات، يتغير العنصر نفسه بالكامل.
العدد الذري ومكونات الذرة (P, N, E)
تتكون الذرة من ثلاثة جسيمات: البروتونات، النيوترونات، والإلكترونات. العدد الذري (Z) هو المفتاح لفهم العلاقة بينها:
- البروتونات (P):
- عدد البروتونات = العدد الذري (Z).
- (هذا هو التعريف).
- شحنتها موجبة (+) وتحدد “هوية” العنصر.
- الإلكترونات (E):
- شحنتها سالبة (-).
- في الذرة المتعادلة كهربائياً، يجب أن تتساوى الشحنات.
- لذلك، في الذرة المتعادلة: عدد الإلكترونات = عدد البروتونات = العدد الذري (Z).
- مثال: الكربون (Z=6) لديه 6 بروتونات و 6 إلكترونات.
- النيوترونات (N):
- شحنتها متعادلة (0).
- عددها لا يؤثر على العدد الذري أو هوية العنصر.
- الذرات التي تنتمي لنفس العنصر (نفس Z) ولكن تختلف في عدد النيوترونات تسمى “النظائر” (Isotopes).
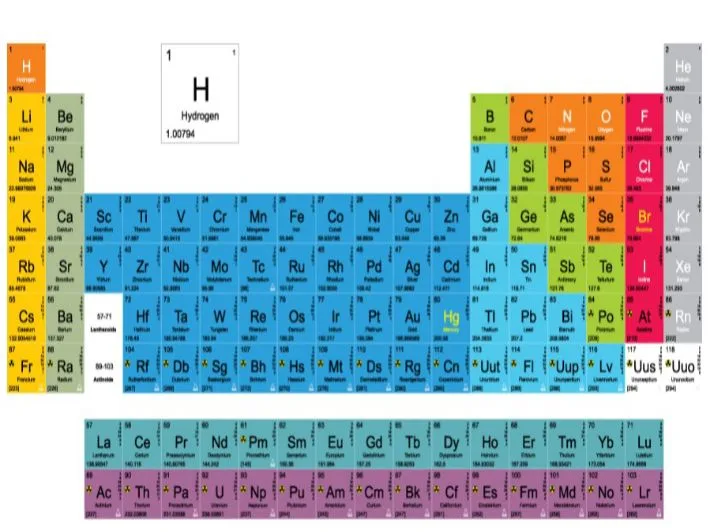
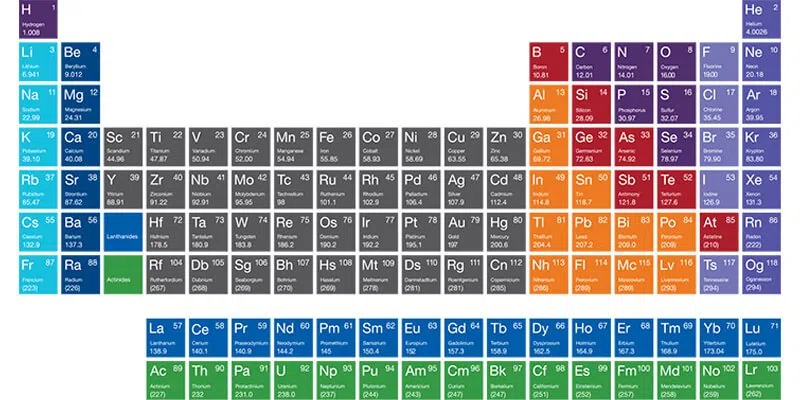
علاقة العدد الذري بالجدول الدوري
الجدول الدوري للعناصر (الذي وضعه ديمتري مندلييف وطُوِّر لاحقاً) هو في الأساس خريطة للعناصر مرتبة تصاعدياً بناءً على أعدادها الذرية (Z).
- يبدأ الجدول بالهيدروجين (Z=1) في الزاوية العلوية اليسرى.
- يليه الهيليوم (Z=2).
- ثم الليثيوم (Z=3)، وهكذا…
- كلما انتقلت من اليسار إلى اليمين في “دورة” (صف)، يزيد العدد الذري بمقدار واحد.
- يصل الجدول حالياً إلى العنصر 118 (الأوغانيسون).
لذلك، العدد الذري (Z) هو الذي يحدد موقع كل عنصر في الجدول الدوري، وهذا الترتيب هو الذي يكشف “الدورية” في خصائص العناصر.
لماذا العدد الذري مهم جداً؟
- يحدد الهوية: كما ذكرنا، هو “بصمة” العنصر.
- يحدد السلوك الكيميائي:
- بما أن العدد الذري يحدد عدد الإلكترونات (في الذرة المتعادلة).
- فإن عدد الإلكترونات يحدد “التوزيع الإلكتروني”، وخاصة عدد “إلكترونات التكافؤ” (الإلكترونات في المدار الأخير).
- إلكترونات التكافؤ هي المسؤولة بشكل مباشر عن كيفية تفاعل العنصر ونوع الروابط التي يشكلها.
أسئلة شائعة (الفرق بين العدد الذري والكتلي)
(س1) ما الفرق بين العدد الذري (Z) والعدد الكتلي (A)؟ هذا هو أهم فرق يجب معرفته:
- العدد الذري (Z): هو عدد البروتونات فقط. (يحدد هوية العنصر).
- العدد الكتلي (A): هو مجموع (عدد البروتونات + عدد النيوترونات). (يحدد كتلة الذرة التقريبية).
(س2) هل العدد الذري يتغير؟ لا. العدد الذري للعنصر ثابت. إذا أضفت بروتوناً إلى الكربون (Z=6)، فإنه لم يعد كربوناً، بل يصبح نيتروجيناً (Z=7).
(س3) هل العدد الذري يساوي دائماً عدد الإلكترونات؟ لا. هو يساوِيها فقط في “الذرة المتعادلة”. إذا فقدت الذرة إلكتروناً (أصبحت أيوناً موجباً) أو اكتسبت إلكتروناً (أصبحت أيوناً سالباً)، يتغير عدد الإلكترونات، لكن العدد الذري (عدد البروتونات) يبقى ثابتاً.
اكتشاف المزيد من عالم المعلومات
اشترك للحصول على أحدث التدوينات المرسلة إلى بريدك الإلكتروني.