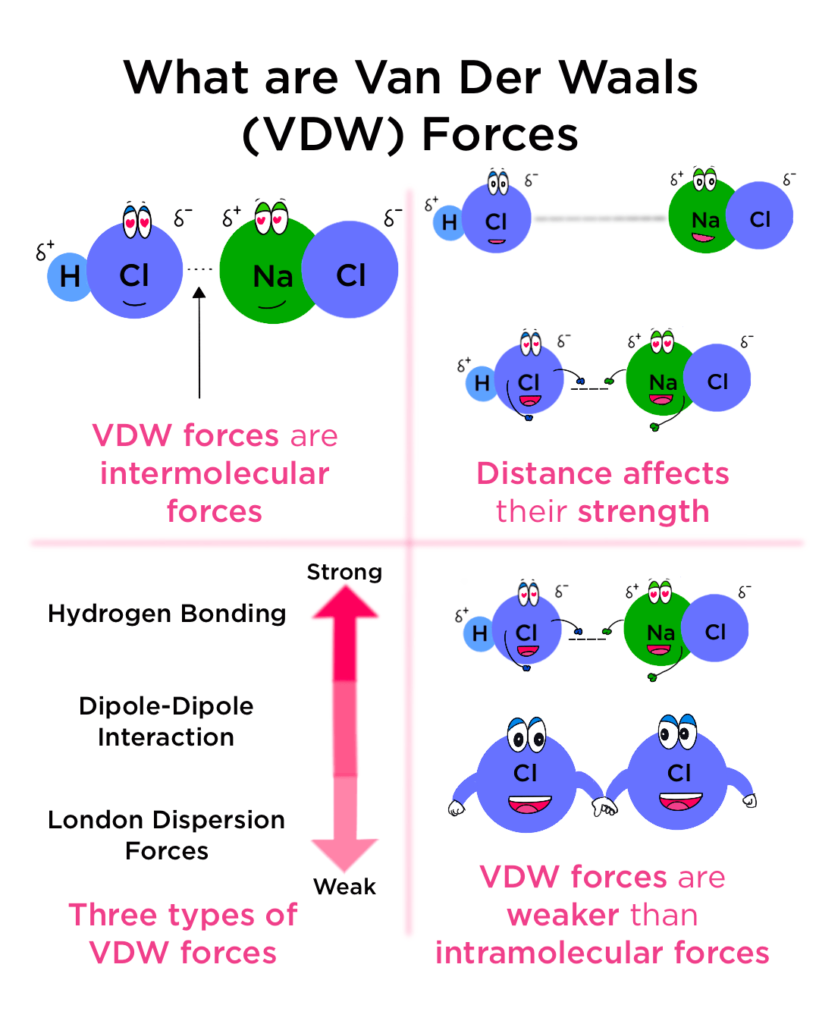
قوى فان درفال هي نوع من القوى الجاذبة التي تعمل بين الجزيئات أو الذرات. هذه القوى أضعف بكثير من الروابط الكيميائية مثل الروابط الأيونية أو التساهمية، ولكنها تلعب دوراً هاماً في العديد من الظواهر الطبيعية. تنشأ قوى فان درفال نتيجة توزيع الشحنات الكهربائية غير المتساوية مؤقتاً داخل الجزيئات. هذا التوزيع غير المتساوي يؤدي إلى ظهور أقطاب مؤقتة (ثنائيات أقطاب) تجذب بعضها البعض.
قوى فان درفال بين الجزيئات
تتنوع أنواع قوى فان درفال، وتشمل قوى لندن (الناشئة عن التذبذبات العشوائية للإلكترونات)، وقوى كيسوم (بين جزيء قطبي وجزيء مستحث)، وقوى ديباي (بين جزيئين قطبيين). تعتمد قوة التجاذب بين الجزيئات على المسافة بينها وحجمها، وزيادة مساحة السطح المتاحة للتفاعل تزيد من قوة التجاذب.
تلعب قوى فان درفال دوراً حاسماً في تحديد خواص المواد مثل درجة الغليان والانصهار، واللزوجة، والقابلية للذوبان، وتبلغ أقصى قوة لها في الحالة الصلبة وأضعفها في الحالة الغازية. كما تؤثر القوى بين الجزيئية بشكل كبير على الخصائص الفيزيائية للمواد، مثل درجة انصهارها وغليانها. وهناك ثلاثة أنواع رئيسية لهذه القوى:
- قوى فان درفال.
- الروابط الهيدروجينية.
- القوى بين الجزيئات القطبية.
الروابط في قوى فان درفال
قوى لندن (التشتت): أضعف الروابط بين الجزيئات
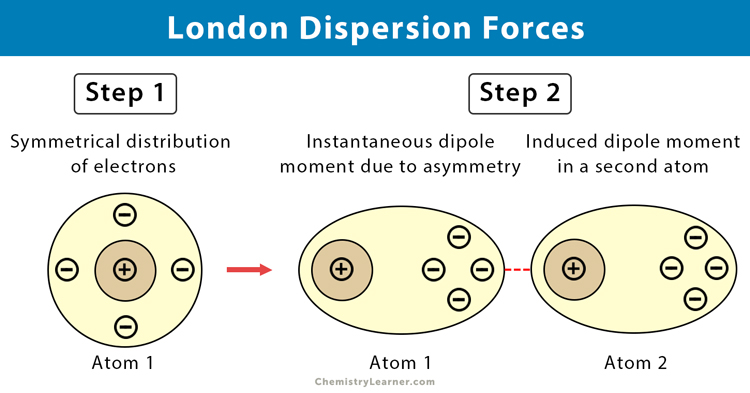
قوى لندن، أو قوى التشتت، هي أضعف أنواع الروابط الكيميائية. تنشأ هذه القوى بين جميع الجزيئات والذرات، حتى تلك التي لا تحمل شحنة كهربائية صافية. تخيل أن الإلكترونات في ذرة أو جزيء تتحرك باستمرار حول النواة. في لحظة معينة، قد تتجمع الإلكترونات أكثر في جانب واحد من الذرة أو الجزيء مما يؤدي إلى تكوين قطب مؤقت (ثنائي قطب). هذا القطب المؤقت يمكن أن يستحث قطباً مؤقتاً معاكساً في ذرة أو جزيء مجاور، مما يؤدي إلى قوة جذب ضعيفة بينهما.
قوى لندن للتشتت بين ذرتين من الغازات النبيلة
ورغم كونها أضعف أنواع الروابط، إلا أن قوى لندن تلعب دوراً حاسماً في العديد من الظواهر الطبيعية. فهي المسؤولة عن:
- تسييل الغازات النبيلة: رغم أن الغازات النبيلة لا تشكل روابط كيميائية، إلا أن قوى لندن بين ذراتها تجعلها تتكثف إلى سوائل عند درجات حرارة منخفضة جداً.
- لزوجة السوائل: كلما زادت قوى لندن بين جزيئات السائل، زادت لزوجته.
- تكوين المواد الصلبة غير القطبية: العديد من المواد الصلبة غير القطبية، مثل اليود، تتكون بسبب قوى لندن القوية بين جزيئاتها.
قوى ديباي: جاذبية بين الأقطاب الدائمة والمؤقتة
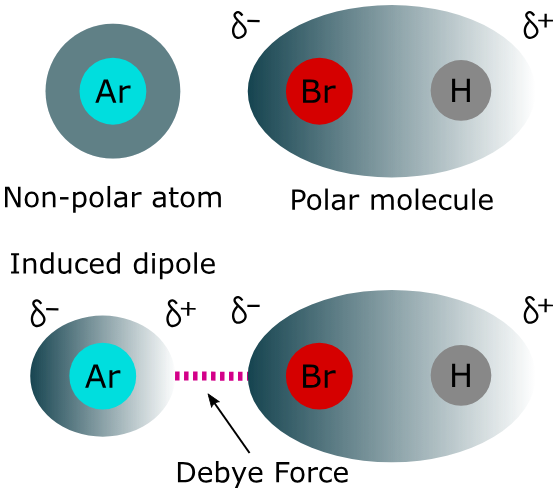
قوى ديباي هي نوع من قوى فان در فال تنشأ بين جزيء قطبي (له قطب موجب وآخر سالب دائم) وجزيء مستقطب (لا يحمل قطباً دائماً ولكنه يمكن أن يستحث قطباً مؤقتاً). عندما يقترب الجزيء القطبي من الجزيء المستقطب، فإن قطبه الموجب يجذب الإلكترونات في الجزيء المستقطب نحو نفسه، مما يخلق قطباً سالباً مؤقتاً في ذلك الجزء من الجزيء المستقطب.
وبالمثل، يجذب القطب السالب في الجزيء القطبي النواة الموجبة في الجزيء المستقطب، مما يخلق قطباً موجباً مؤقتاً. هذه الأقطاب المتقابلة تجذب بعضها البعض، مما يؤدي إلى قوة جذب إضافية بين الجزيئين.
قوى ديباي بين جزيء قطبي وجزيء غير قطبي
قوى كيسوم: جاذبية بين الأقطاب الدائمة
قوى كيسوم هي نوع من قوى فان در فال تنشأ بين جزيئين قطبيين. الجزيء القطبي هو جزيء يحمل شحنة موجبة جزئية في أحد طرفيه وشحنة سالبة جزئية في الطرف الآخر. عندما يقترب جزيئان قطبيان من بعضهما البعض، فإن الطرف الموجب لأحد الجزيئات يجذب الطرف السالب للجزيء الآخر، والعكس صحيح. هذه القوة الجاذبة بين الأقطاب المتقابلة تسمى بقوة كيسوم.
خصائص قوى فان درفال
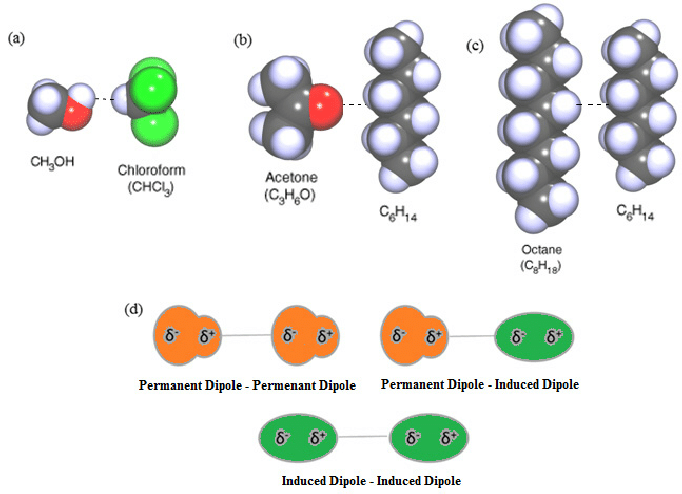
تتميز بمجموعة من الخصائص، من أهمها:
- لا تتأثر بدرجات الحرارة باستثناء قوى كيسوم.
- تعتمد على المسافة بين الجزيئات فكلما كانت الجزيئات قريبة كلما كانت الرابطة أقوى.
- تعتبر رابطة ضعيفة بالمقارنة مع الروابط الكيميائية الأخرى (المشتركة والأيونية).
- تعتمد قوتها على عدد الإلكترونات والكتلة الجزيئية للمادة مثلاً “درجة غليان الكلور أعلى من درجة غليان الفلور لأن الكتلة الجزيئية للكلور أكبر من الكتلة الجزيئية للفلور”، وكذلك شكل الجزيء حيث تميل للجزيئات الطويلة نوعاً ما وغير المتشعبة.
- تتصف بأنها قوى تراكمية وغير متجهة.
لماذا سُميت باسم قوى فان درفال؟
سُميت قوى التجاذب الضعيفة التي تربط الجزيئات والذرات المحايدة ببعضها باسم “قوى فان درفال” أو قوى فان دير فاس Van der Waals forces نسبة إلى العالم الهولندي جوناس ديدريك فان دير فاس أو والاس Johannes Diderik van der Waals، الذي طرح هذه الفكرة في منتصف القرن التاسع عشر تحديدا في عام 1873.
هذه القوى تلعب دورًا حاسمًا في تماسك المواد المختلفة، بدءًا من الغازات والسوائل وحتى المواد الصلبة العضوية. وبالرغم من ضعفها النسبي مقارنة بالقوى الأيونية أو الروابط المعدنية، إلا أنها تؤثر بشكل كبير على خواص المواد التي تتكون منها. فالمواد التي تترابط بفضل قوى فان درفال تميل إلى أن تكون ذات نقاط انصهار وغليان أقل، كما أنها تكون أكثر نعومة وخفة من المواد التي تترابط بروابط أقوى.
إن فهم هذه القوى الأساسية يساعدنا على تفسير العديد من الظواهر الطبيعية، بدءًا من سلوك الغازات وحتى خصائص المواد الصلبة التي نستخدمها يوميًا. ولتوضيح الأمر أكثر، يمكن تشبيه قوى فان درفال بقوى الجذب الضعيفة بين قطع المغناطيس الصغيرة، حيث تتجاذب هذه القطع بفضل قوى مغناطيسية ضعيفة، ولكن إذا زادت هذه القطع أو أصبحت قريبة بشكل كافٍ، فإن قوة التجاذب بينها ستزداد بشكل ملحوظ. وبالمثل، فإن قوى فان درفال تزداد قوتها مع زيادة حجم الجزيئات أو مع تقاربها من بعضها البعض.
مصادر قوى فان درفال
تعد قوى فان در فال نوعًا من قوى التجاذب الضعيفة التي تحدث بين الجزيئات، سواء كانت قطبية أو غير قطبية. هذه القوى تلعب دورًا حاسمًا في العديد من الظواهر الطبيعية، مثل تكوين السوائل والصلب، وتماسك المواد غير القطبية. تنشأ قوى فان در فال من توزيع الشحنات الكهربائية غير المتساوية بشكل مؤقت أو دائم داخل الجزيئات. هناك ثلاثة مصادر رئيسية لهذه القوى:
- الأقطاب الثنائية الدائمة: بعض الجزيئات، مثل جزيء الماء، تمتلك توزيعًا غير متساو للشحنات الكهربائية، مما يخلق قطبين موجب وسالب. تتجاذب هذه الأقطاب الثنائية مع الأقطاب المعاكسة في الجزيئات المجاورة، مما يؤدي إلى قوة تجاذب.
- الأقطاب المستحثة: عندما يقترب جزيء ذو قطب ثنائي دائم من جزيء غير قطبي، فإن القطب الثنائي الدائم يحفز إعادة توزيع الشحنات في الجزيء غير القطبي، مما يخلق قطبًا مستحثًا. يتجاذب القطب الثنائي الدائم مع القطب المستحث، مما يؤدي إلى قوة تجاذب إضافية.
- الأقطاب اللحظية: حتى في الجزيئات غير القطبية، يمكن أن تحدث تذبذبات في توزيع الإلكترونات، مما يؤدي إلى ظهور أقطاب ثنائية لحظية. تتجاذب هذه الأقطاب اللحظية مع الأقطاب اللحظية في الجزيئات المجاورة، مما يؤدي إلى قوة تجاذب ضعيفة.
اكتشف العالم فريتز لندن هذه القوى في عام 1930، ووصفها بأنها ناتجة عن التذبذبات المستمرة في توزيع الإلكترونات داخل الجزيئات. على الرغم من أن هذه القوى ضعيفة مقارنة بالروابط الكيميائية الأخرى، إلا أنها تلعب دورًا حاسمًا في تحديد العديد من الخصائص الفيزيائية والكيميائية للمواد، مثل نقطة الغليان ونقطة الانصهار واللزوجة.
باختصار، قوى فان در فال هي قوى تجاذب ضعيفة تنشأ بين جميع الجزيئات، وهي نتيجة لتوزيع الشحنات الكهربائية غير المتساوية بشكل مؤقت أو دائم. هذه القوى تلعب دورًا هامًا في تفسير العديد من الظواهر الطبيعية وتساهم في تماسك المادة.
قوى التشتت
تخيل الإلكترونات في الذرات كسحابة متذبذبة حول النواة. في لحظات معينة، قد تتجمع هذه السحابة الإلكترونية بشكل أكبر في أحد جوانب الذرة، مما يخلق شحنة سالبة مؤقتة في ذلك الجانب وشحنة موجبة مؤقتة في الجانب الآخر. هذه الشحنات المتقابلة المؤقتة، التي تسمى ثنائيات الأقطاب اللحظية، لا تدوم طويلاً بل تتغير باستمرار.
رغم عدم قدرتها على التوجيه الدائم نحو بعضها البعض، إلا أنها تستطيع التأثير على توزيع الإلكترونات في الذرات المجاورة، مما يؤدي إلى ظهور ثنائيات أقطاب مستحثة تتجاذب مع الثنائيات اللحظية الأصلية. هذه التفاعلات المتبادلة بين الثنائيات اللحظية والمستحثة هي ما نسميه قوى التشتت أو قوى لندن.
تعتبر قوى التشتت أضعف أنواع التجاذب بين الجزيئات، إلا أنها موجودة في جميع المواد، حتى تلك التي تتكون من جزيئات غير قطبية. علاوة على ذلك، حتى في الجزيئات القطبية التي تمتلك شحنة دائمة، تلعب قوى التشتت دورًا هامًا، فهي غالبًا ما تكون المساهم الأكبر في القوى الكلية بين الجزيئات.
وبالتالي، يمكن القول إن قوى التشتت هي القوة الدافعة وراء تفاعل العديد من المواد مع بعضها البعض، بدءًا من تكوين السوائل والصلب وانتهاءً بتكوين المركبات الكيميائية المعقدة.
اكتشاف المزيد من عالم المعلومات
اشترك للحصول على أحدث التدوينات المرسلة إلى بريدك الإلكتروني.







